肝内胆管癌(ICC)是第二大常见的原发性肝癌,具有高度恶性且预后极差,5年生存率低于10%。目前,手术切除术是主要治疗手段,但对于无法切除或晚期疾病的患者,现有疗法效果有限。ICC中脂质合成受抑,但氨基酸和核苷酸代谢异常活跃,提示其可能依赖该通路维持恶性增殖。SIRT6(Sirtuin(沉默信息调节因子)家族成员)作为NAD⁺依赖的去乙酰化酶,既往在多种癌症中被视为抑癌基因,可通过调控糖脂代谢抑制肿瘤,但在ICC中作用未知。
2025年10月,华中科技大学同济医学院研究团队在Gut上在线发表了题为“SIRT6 promotes intrahepatic cholangiocarcinoma development by reprogramming glutamine metabolism via enhanced GLUL”的研究文章,通过多组学+多模型策略,发现SIRT6在肝内胆管癌中作为癌基因,通过增强GLUL的转录激活与蛋白稳定性调控谷氨酰胺代谢重编程,靶向SIRT6-GLUL轴可抑制ICC进展并提升化疗敏感性,为ICC治疗提供新策略。(麦特绘谱提供有机酸+代谢流(15N-NH4CL)技术检测服务)
研究设计
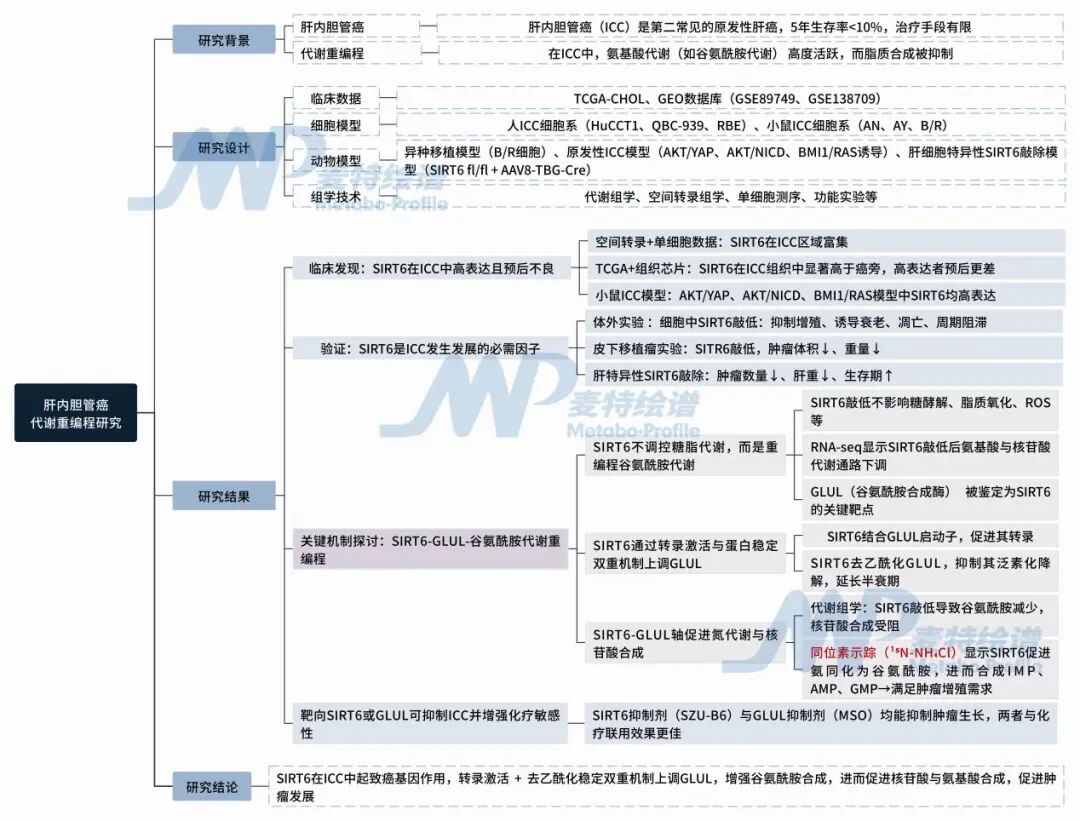
图1. 技术思路
研究结果
1. SIRT6在ICC中高表达,与预后不良有关
通过空间转录数据(GSE89749)和单细胞测序数据(GSE138709),发现SIRT6高表达细胞簇与ICC区域富集相关,在TCGA-CHOL和GSE107943数据库中也验证了人类ICC肿瘤组织中SIRT6 mRNA水平显著升高。此外,SIRT6在临床ICC组织中显著高于癌旁且高表达者预后更差,在AKT/YAP等小鼠ICC模型中也证实SIRT6高表达。
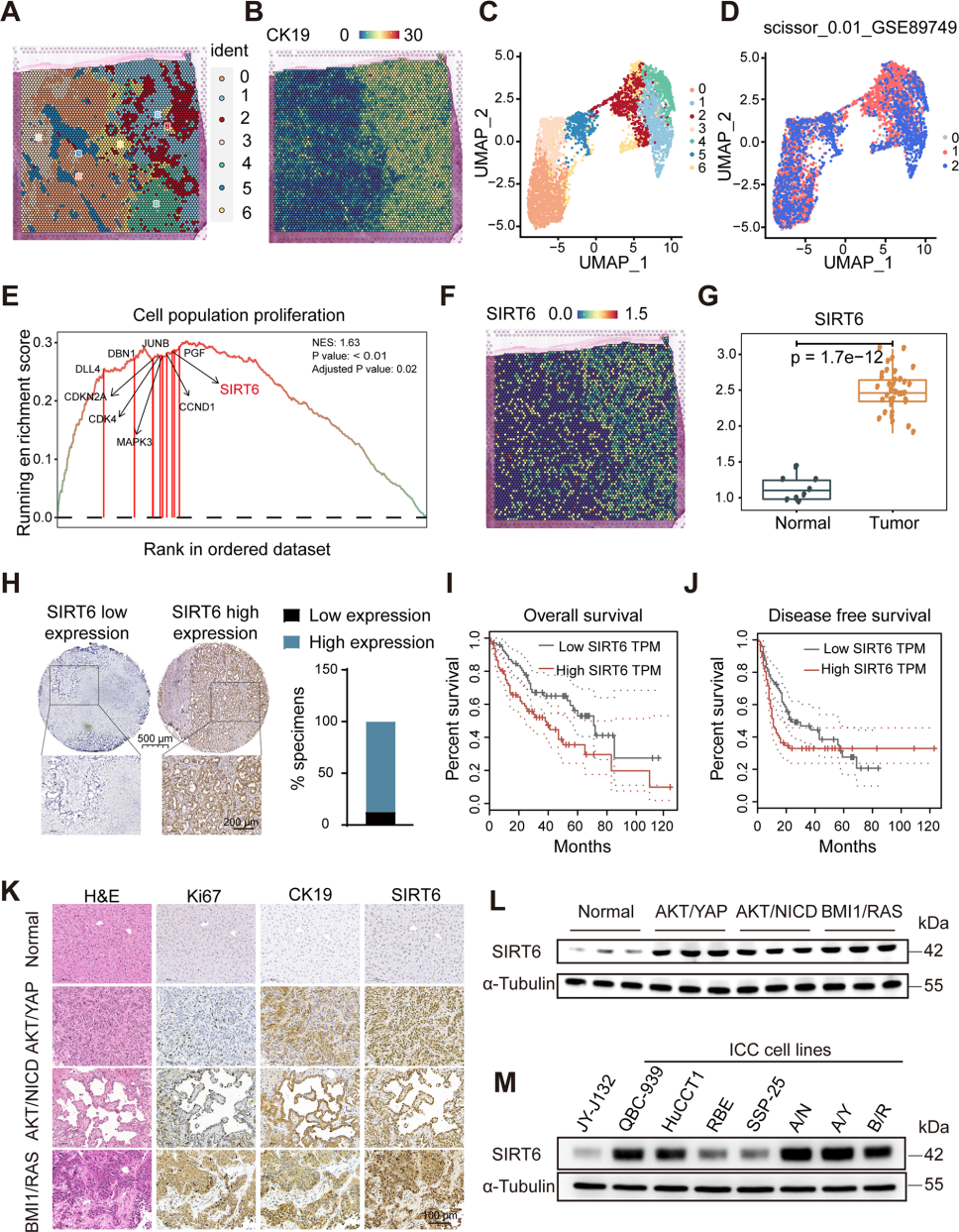
图2. 肝组织中SIRT6表达上调与肝细胞癌患者预后不良相关
2. SIRT6促进ICC细胞增殖与肿瘤形成
进一步探究SIRT6的功能,在人和小鼠的ICC细胞中敲低SIRT6发现其抑制细胞活力并诱导细胞衰老及凋亡;过表达则促进RBE细胞(人肝内胆管癌细胞系)存活增殖;在B/R小鼠ICC细胞构建的皮下移植瘤模型中,SIRT6敲低显著减小肿瘤体积和重量,延长AKT/YAP诱导的ICC小鼠生存期;在肝特异性敲除SIRT6小鼠中,同样延迟了AKT/YAP诱导的ICC形成。
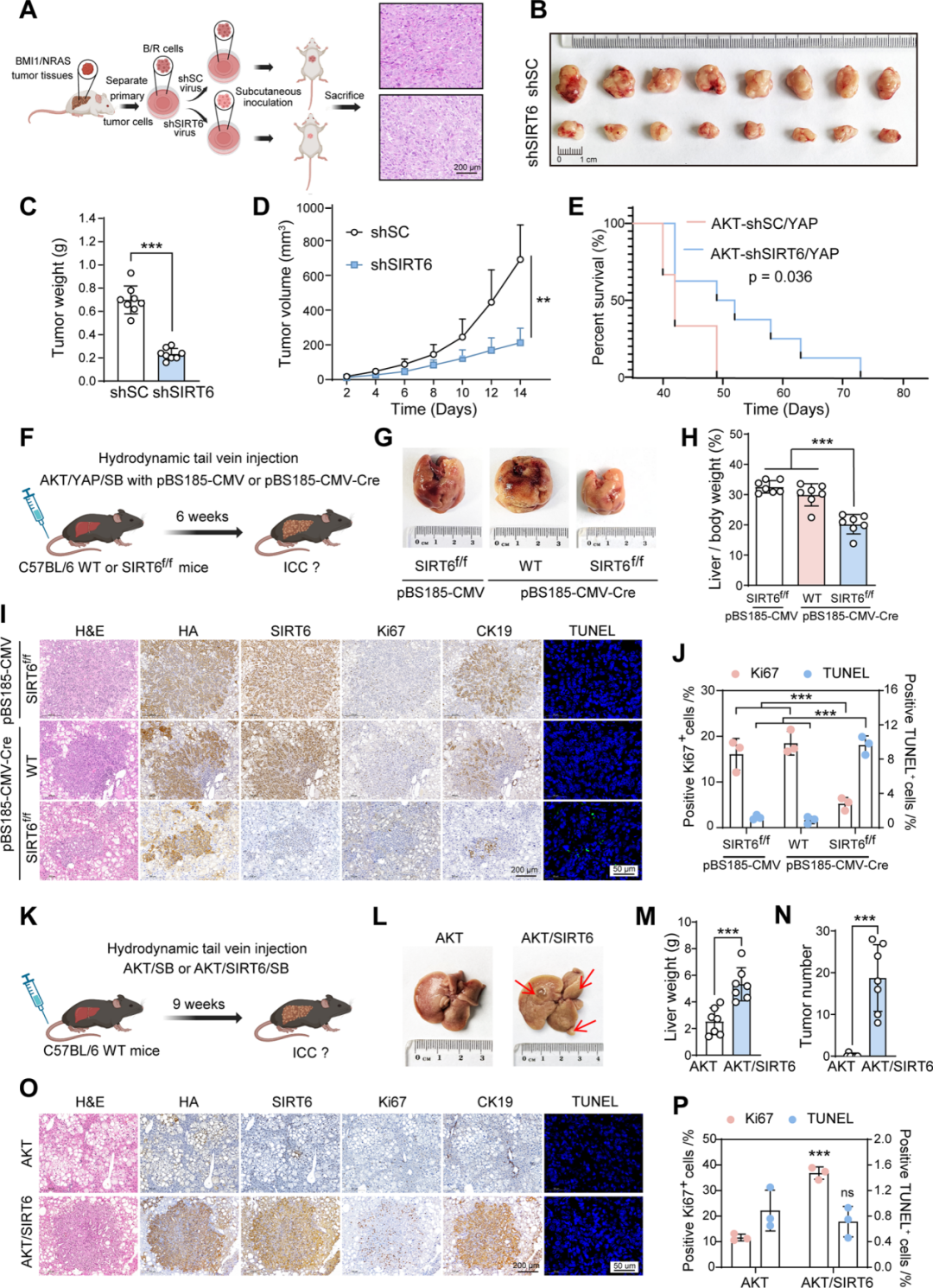
图3. SIRT6是ICC发生发展的关键驱动因子
3. SIRT6不调控糖脂代谢,而是通过GLUL调控谷氨酰胺代谢
● SIRT6不调节ICC的糖脂代谢及氧化还原动态平衡
既往研究表明,SIRT6在不同类型的癌症中调节葡萄糖和脂肪代谢。进一步在ICC细胞和组织中进行了探索,发现SIRT6敲低不影响ICC细胞的脂质β-氧化速率 (OCR)和糖酵解速率 (ECAR) 。在氧化应激调节中,SIRT6基因敲除对ICC细胞中的还原型谷胱甘肽(GSH)、氧化谷胱甘肽(GSSG)或活性氧物种(ROS)水平几乎没有影响。
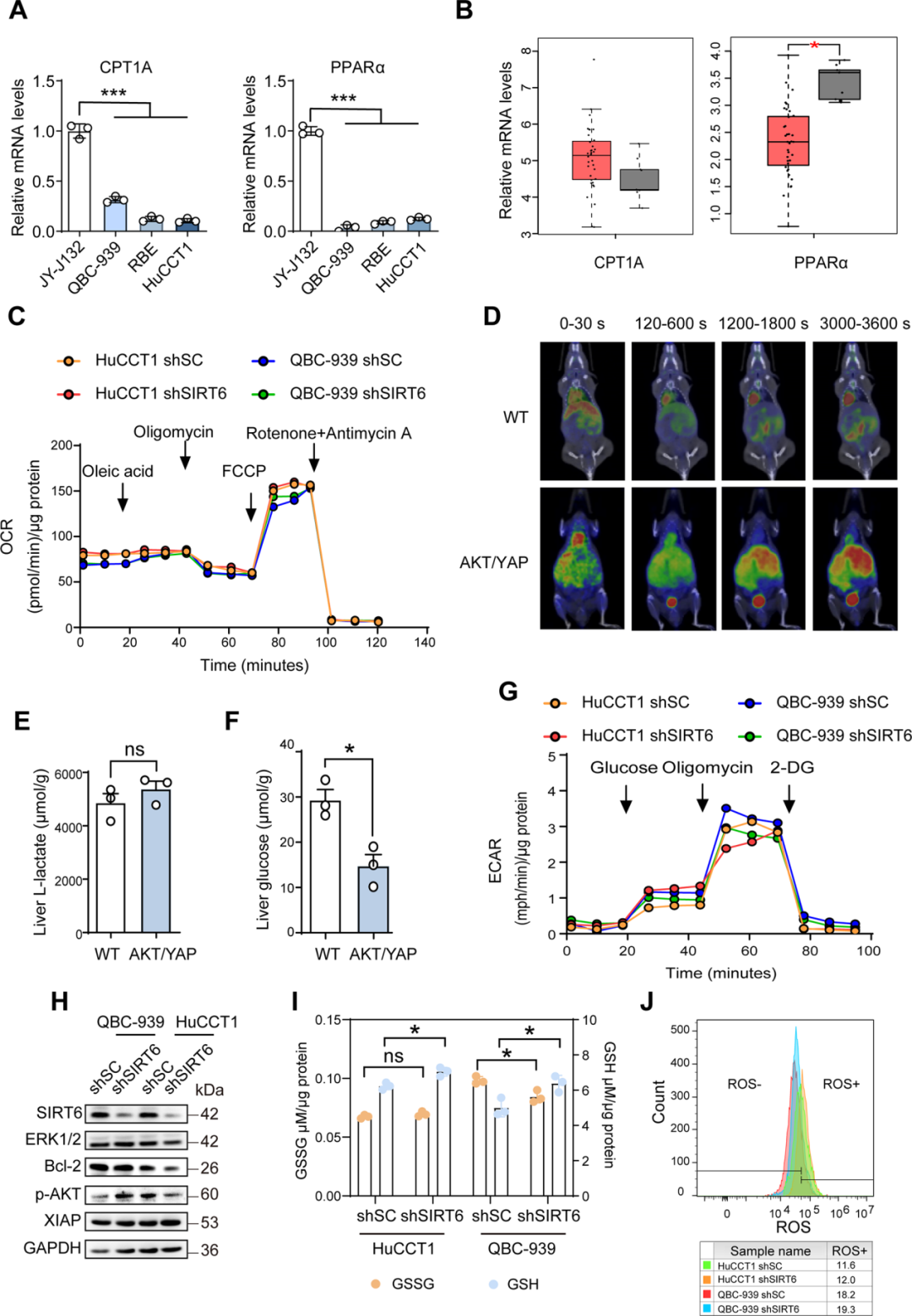
图4. 验证SIRT6在促进ICC细胞生长中的潜在功能
●SIRT6增强ICC谷氨酰胺代谢
RNA测序结果表明,在SIRT6基因敲除后,ICC细胞的氨基酸生物合成和嘌呤代谢途径下调,且谷氨酰胺水平降低,添加谷氨酰胺可增强OXPHOS,而SIRT6敲低则减弱此效应,表明SIRT6影响了谷氨酰胺供养的TCA循环。通过靶向代谢组学对TCA通路循环通量进行测定,证实在SIRT6沉默后,TCA通路明显被抑制。
●SIRT6通过GLUL调控谷氨酰胺代谢
RNA测序结果发现在排名前20位的基因中,GLUL是与谷氨酰胺代谢相关的排名最高的基因。此外,qRT-PCR和Western blot证实SIRT6调节ICC细胞和AKT/YAP ICC组织中GLUL的mRNA和蛋白水平以及催化活性。免疫染色显示39对ICC患者的FFPE标本中SIRT6和GLUL蛋白水平呈正相关,证实GLUL是SIRT6调控谷氨酰胺代谢的关键靶点。
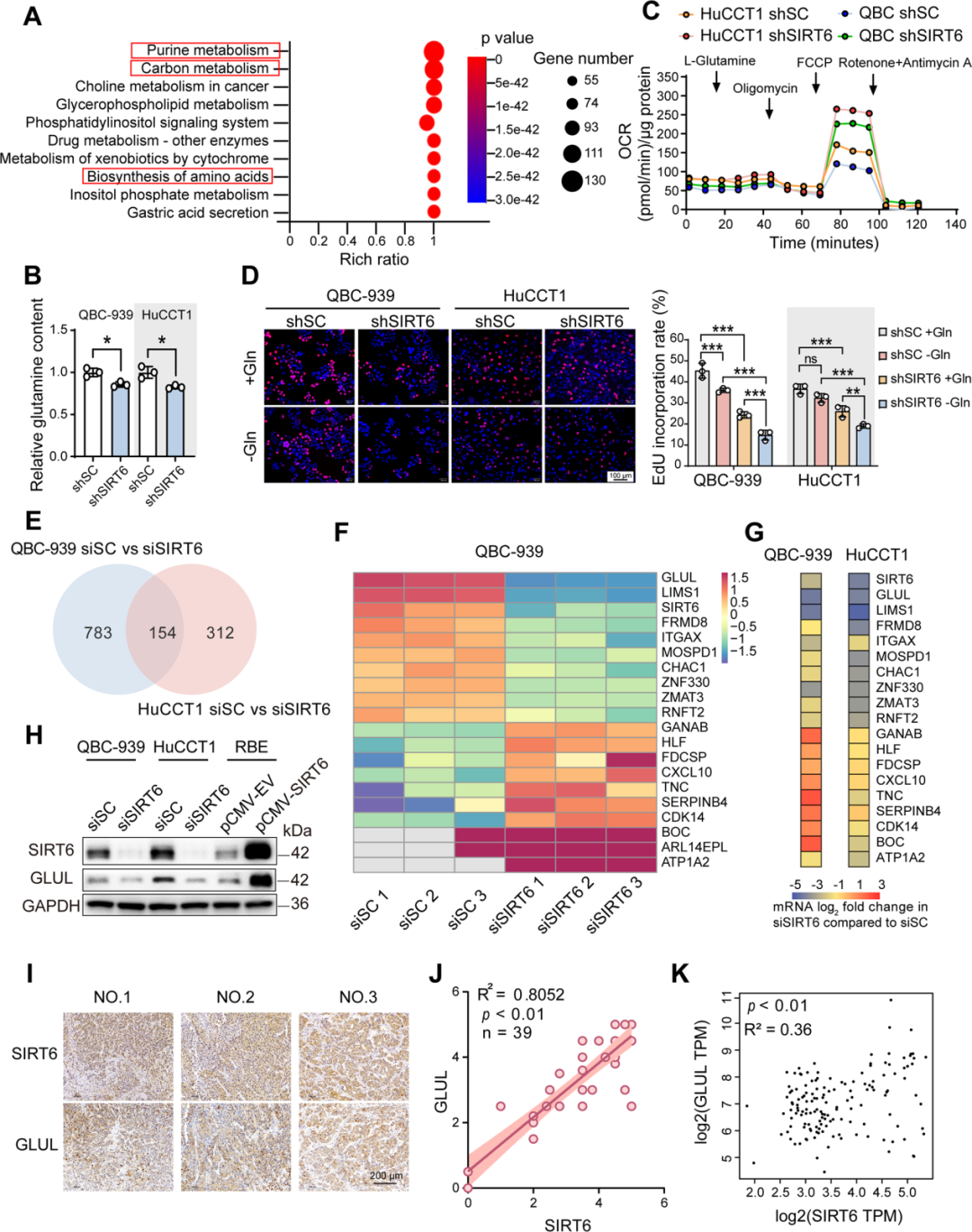
图5. SIRT6对ICC中谷氨酰胺代谢的调节
4. SIRT6通过转录激活与蛋白稳定双重机制上调GLUL
进一步探究SIRT6是否作为转录因子直接促进GLUL表达,发现过表达SIRT6的293T和RBE细胞中,GLUL的mRNA水平显著上调。荧光素酶报告基因和染色质免疫沉淀实验表明,SIRT6能结合GLUL启动子,促进其转录。
基于GLUL乙酰化会促进其泛素化和蛋白酶体降解,研究了SIRT6能否通过去乙酰化稳定GLUL蛋白。敲低SIRT6缩短了QBC-939和HuCCT1细胞中GLUL的半衰期,表明其降解加速;过表达SIRT6可降低GLUL乙酰化,而催化失活突变体则增加乙酰化,表明SIRT6直接去乙酰化GLUL。
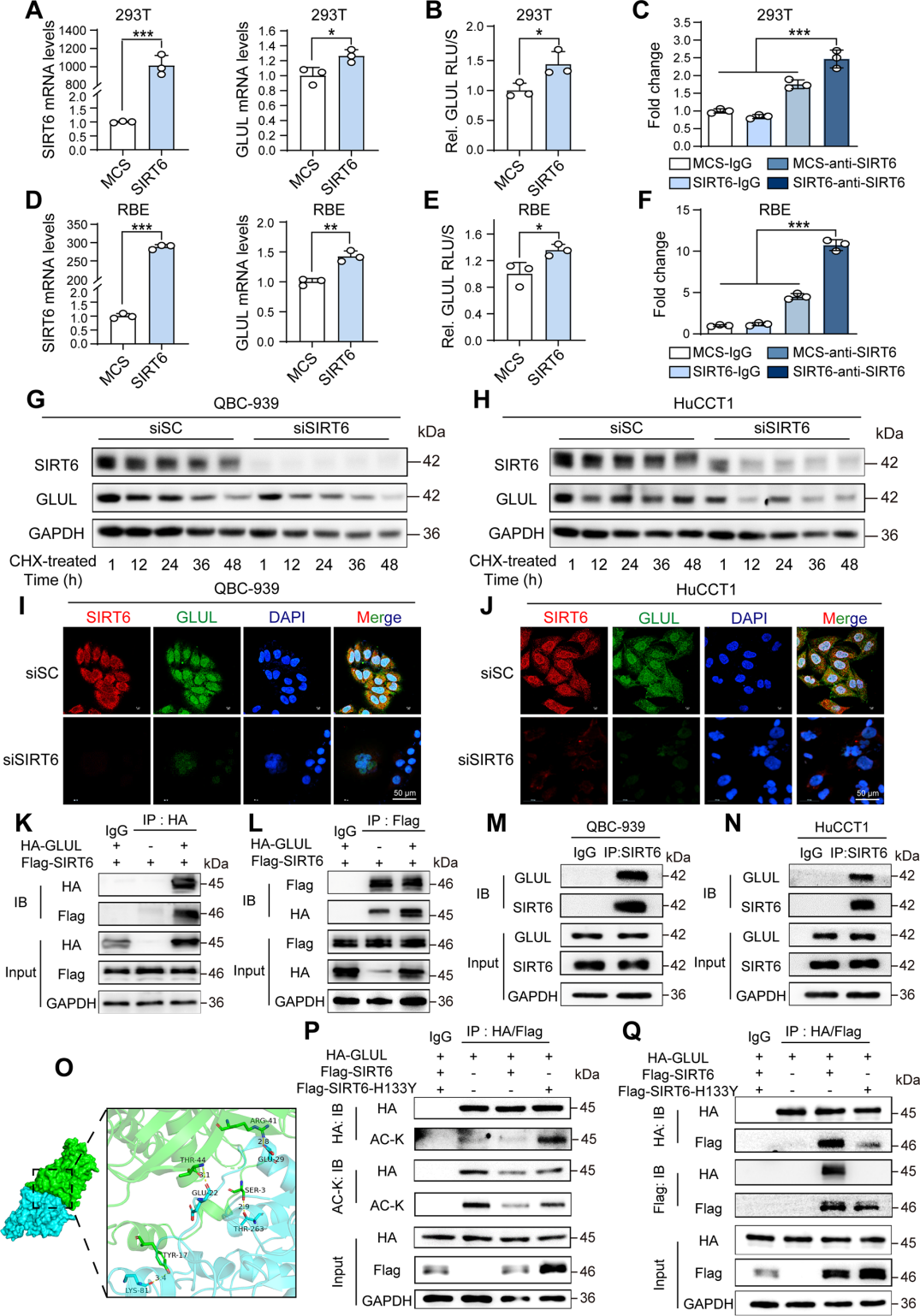
图6. SIRT6增强GLUL转录并防止其降解
5. SIRT6-GLUL轴促进氮代谢与核苷酸合成
通过代谢组学进一步分析了SIRT6激活对ICC细胞代谢的影响,发现SIRT6敲低导致多种代谢物变化,尤其富集于核苷酸、氨基酸及其衍生物。进一步通过15N-NH4Cl同位素示踪代谢流技术发现SIRT6沉默减少了新合成IMP, AMP, GMP核苷酸的比例,15N标记的谷氨酰胺含量减少,谷氨酸含量增加,GLUL过表达可恢复此效应。在GSE89749数据集中,ICC患者的SIRT6表达水平和核苷酸含量之间存在显著的正相关。上述结果表明,SIRT6通过GLUL促进谷氨酰胺利用,进而支持核苷酸和氨基酸生物合成,满足肿瘤快速增殖合成的生物需求。
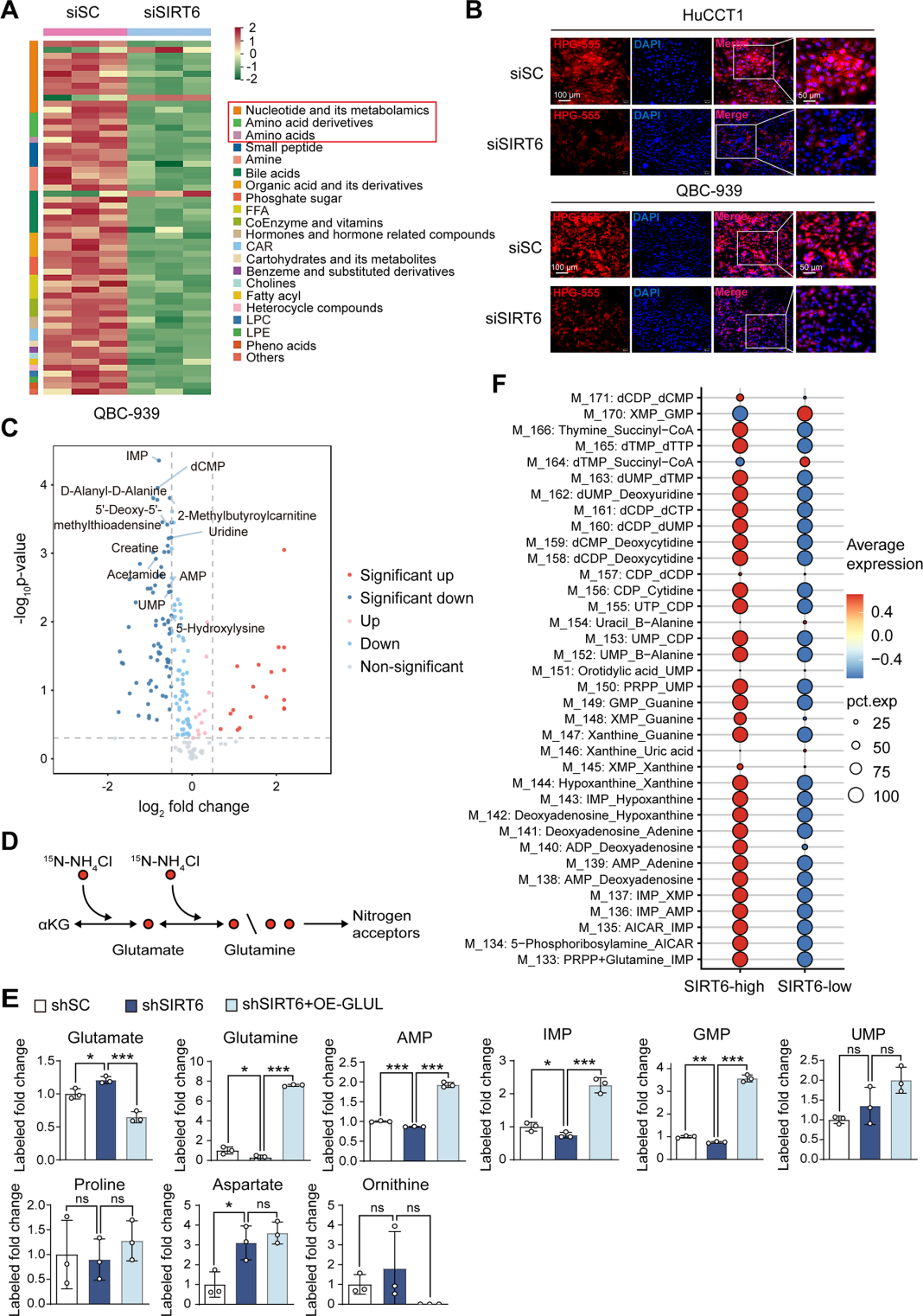
图7.SIRT6沉默抑制ICC细胞的核苷酸和氨基酸代谢
6. 靶向SIRT6或GLUL可抑制ICC并增强化疗敏感性
在AKT/YAP ICC小鼠模型中,SIRT6抑制剂(SZU-B6)和GLUL抑制剂(MSO)均能显著抑制肿瘤生长 (图5Q-S)。两者均能协同增强吉西他滨/顺铂化疗效果 (图5Q-S)。而抗PD-1单一治疗没有显示出抗肿瘤活性,且抑制剂不增强其疗效。
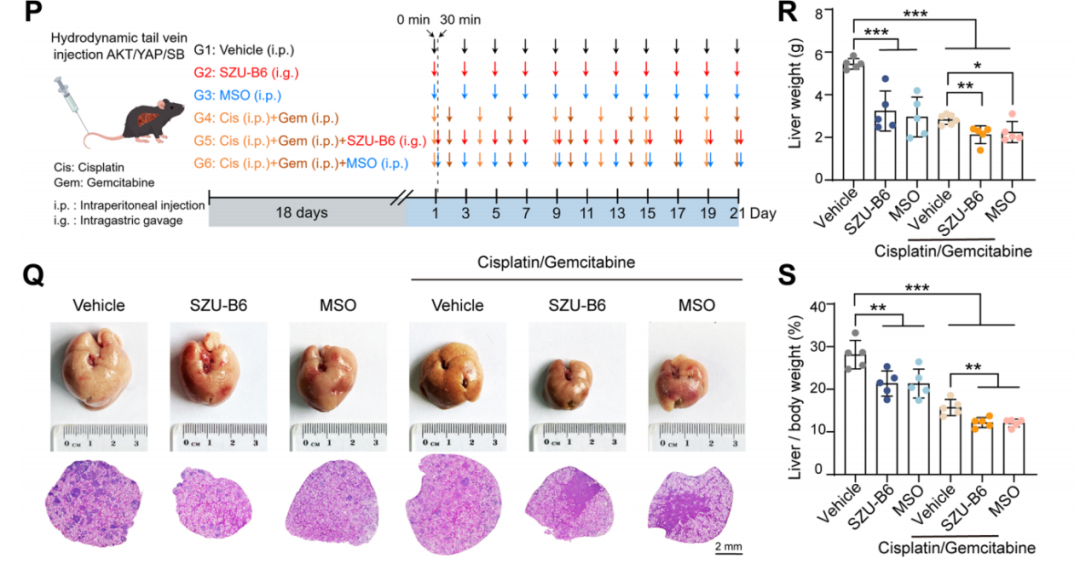
图8. 靶向SIRT6或GLUL可抑制ICC并增强化疗敏感性
研究结论
在不同癌症类型中,SIRT6可表现为肿瘤抑制因子或肿瘤促进因子。本研究揭示了SIRT6在ICC中作为促癌基因的新功能,明确SIRT6通过转录激活和翻译后稳定 GLUL,调控谷氨酰胺代谢重编程,为ICC细胞增殖提供代谢支持的核心机制。证实SIRT6-GLUL轴是ICC治疗的潜在靶点,抑制剂单独使用或与化疗联合均可有效抑制ICC进展,为临床治疗提供新方向。
参考文献
SIRT6 promotes intrahepatic cholangiocarcinoma development by reprogramming glutamine metabolism via enhanced GLUL. Gut. 2025
绘谱帮你测
本研究中通过代谢组学发现SIRT6对ICC细胞的氨基酸生物合成及嘌呤代谢通路具有关键调控作用,结合麦特绘谱提供的15N-NH4Cl同位素示踪技术进一步证实,SIRT6通过增强GLUL介导的谷氨酰胺合成,推动氨的氮同化过程并为核苷酸生物合成提供前体,最终驱动ICC的发生发展。麦特绘谱开创性地搭建了医学领域高端代谢组学技术平台,覆盖了非靶向-全定量-代谢流等全方位的高端医学代谢组解决方案,同时全面布局微生物组学、转录组学和蛋白质组学等多组学技术服务,已成为全球多组学研究者的优选合作伙伴。麦特绘谱已为数百家三甲医院、科研院所和企业提供多组学一站式整体解决方案,协助客户与合作伙伴发表SCI文章600+篇,累计影响因子6000+,平均IF>10,涵盖Cell, Science, Nature, Cancer Cell, Signal Trans-duction and Targeted Therapy, Nature Biotechnology, Cell Metabolism等权威期刊。
